Περιγραφή προϊόντων
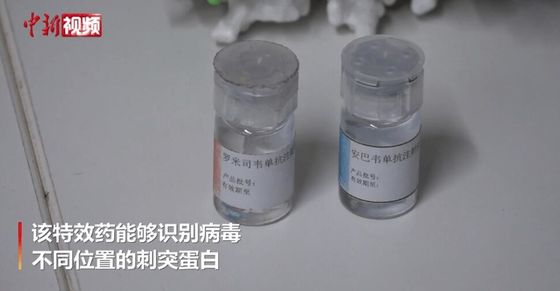
Αμουμπαρβιμάμ / Ρομλουσεβιμάμ (BRII-196/ BRII-198) Μονοκλωνικό αντισώμα Περιγραφή
Τα BRII-196 και BRII-198 δεν ανταγωνίζονται το SARS-CoV-2μονοκλωνικά εξουδετερωτικά αντισώματαπροέρχονται από ασθενείς που έχουν αναρρώσει από το COVID-19.Τα μονοκλωνικά αντισώματα έχουν σχεδιαστεί ειδικά για να μειώσουν τον κίνδυνο αύξησης που εξαρτάται από τα αντισώματα και να παρατείνουν τους χρόνους ημιζωής στο πλάσμα για πιθανό πιο μακροχρόνιο αποτέλεσμα της θεραπείας.Επιπλέον, οι μη επικαλυπτόμενες περιοχές δέσμευσης των επιτόπων τους παρέχουν υψηλό βαθμό δραστηριότητας εξουδετέρωσης κατά τηςSARS-CoV-2βήτα κορονοϊός.
Ο συνδυασμόςBRII-196/BRII-198βΕκτός από τη συνεργασία με το NIAID, η Brii Biosciences διεξάγει πρόσθετες μελέτες στην Κίνα.για την αξιολόγηση της φαρμακοκινητικής και της ασφάλειας του συνδυασμού BRII-196/BRII-198 και μελέτης αποτελεσματικότητας Φάσης 2 του συνδυασμού BRII-196/BRII-198 για τη θεραπεία του COVID-19.
Η Εταιρεία επιβεβαίωσε ότι είχαν υποβληθεί αιτήσεις έρευνας για το νέο φάρμακο για τη θεραπεία συνδυασμού στην Υπηρεσία Τροφίμων και Φαρμάκων των ΗΠΑ.
ΗΚίνα Εθνική Υπηρεσία Ιατρικών Προϊόντων(NMPA) χορήγησε έγκριση στις 9 Δεκεμβρίου 2021 για τον συνδυασμό amubarvimab/romlusevimab (προηγουμένως συνδυασμός BRII-196/BRII-198)για τη θεραπεία σε ενήλικες και παιδιατρικούς ασθενείς(ηλικίας 12-17 ετών με βάρος τουλάχιστον 40 kg) με τον ήπιο και φυσιολογικό τύπο του COVID-19, με υψηλό κίνδυνο εξέλιξης σε σοβαρή ασθένεια, συμπεριλαμβανομένης της νοσηλείας σε νοσοκομείο ή θανάτου.μελέτη φάσης 3final results demonstrated a statistically significant 80% (78% in interim results) reduction of hospitalization and death with fewer deaths through 28 days in the treatment arm (0) relative to placebo (9), και βελτιωμένα αποτελέσματα ασφάλειας σε σχέση με το εικονικό φάρμακο σε ασθενείς που δεν νοσηλεύονται στο νοσοκομείο με COVID-19 με υψηλό κίνδυνο κλινικής εξέλιξης σε σοβαρή ασθένεια.Παρόμοια ποσοστά αποτελεσματικότητας παρατηρήθηκαν σε συμμετέχοντες που ξεκίνησαν την θεραπεία νωρίς (0 - 5 ημέρες) και αργά (6 - 10 ημέρες)., μετά την έναρξη των συμπτωμάτων, παρέχοντας κρίσιμα απαραίτητα κλινικά στοιχεία σε ασθενείς με COVID-19 που καθυστέρησαν στη θεραπεία.
Μπρι Βιο(κωδικός αποθέματος:2137ΧΚ.) είναι μια πολυεθνική εταιρεία με έδρα το Durham, N.C., Ηνωμένες Πολιτείες, και το Πεκίνο, Κίνα, που αναπτύσσει καινοτόμες θεραπείες για ασθένειες με σημαντικές ανεκπλήρωτες ιατρικές ανάγκες.Η Brii Biosciences Limited έχει συμπεριληφθεί ως συστατικό κεφάλαιο τηςΧανγκ ΣενγκΣυνθετικός Δείκτης. Οκτώβριος 2021 εταιρικήπαρουσίαση. Στις 5 Δεκεμβρίου 2021, η Brii Biosciences Limited προστέθηκε στηνΧονγκ ΚονγκΣυνδεθείτε.
Αμουμπαρβιμάμπ / Ρομλουσεβιμάμπ (BRII-196/ BRII-198) Μονοκλωνικό ιστορικό αντισωμάτων
Στις αρχές του 2020, η ΕταιρείαΣυνεργαζόμενοιμε το Πανεπιστήμιο Tsinghua και το Νοσοκομείο Τρίτου Λαού του Shenzhen για την ίδρυση της TSB Therapeutics για την ανάπτυξη των BRII-196 και BRII-198.Το Amubarvimab και το Romlusevimab είναι μη ανταγωνιστικά μονοκλωνικά αντισώματα που εξουδετερώνουν το SARS-CoV-2 που προέρχονται από θεραπευμένους ασθενείς με COVID-19..
Σε λιγότερο από 20 μήνες,Η Brii Bio προχώρησε.ο συνδυασμός amubarvimab/romlusevimab από την ανακάλυψη μέχρι την ολοκλήρωση της φάσης 3 της ανάπτυξης που οδηγεί σε αυτή την ταχεία έγκριση από την NMPA.Αυτή η έγκριση αντιπροσωπεύει την πολύ επιτυχημένη συνεργασία με τους καλύτερους επιστήμονες και κλινικούς ερευνητές στην Κίνα και σε όλο τον κόσμο σε μια κοινή αποστολήΤο Εθνικό Ινστιτούτο Υγείας των ΗΠΑ, η Κλινική Ομάδα Δοκιμών του AIDS,που χρηματοδότησε και ηγήθηκε της μελέτης ACTIV-2.
Αμουμπαρβιμάμ / Ρομλουσβιμάμ (BRII-196/ BRII-198) Μονοκλωνικά αντισώματα Ενδείξεις
Το BRII-196/ BRII-198 μονοκλωνικό αντισώμα είναιυποδεικνύεταιγια τη θεραπεία μη νοσηλευτικών ασθενών με COVID-19 που διατρέχουν υψηλό κίνδυνο κλινικής εξέλιξης.Παιδιατρικοί ασθενείς(ηλικίας 12-17 ετών με βάρος τουλάχιστον 40 kg) υπόκειται σε υπό όρους έγκριση στην Κίνα.

 Το μήνυμά σας πρέπει να αποτελείται από 20-3.000 χαρακτήρες!
Το μήνυμά σας πρέπει να αποτελείται από 20-3.000 χαρακτήρες! Παρακαλούμε ελέγξτε το email σας!
Παρακαλούμε ελέγξτε το email σας!  Το μήνυμά σας πρέπει να αποτελείται από 20-3.000 χαρακτήρες!
Το μήνυμά σας πρέπει να αποτελείται από 20-3.000 χαρακτήρες! Παρακαλούμε ελέγξτε το email σας!
Παρακαλούμε ελέγξτε το email σας!